Imagen: Para producir electricidad, la pila de combustible funciona aprovechando la energía de una reacción electroquímica entre un combustible, como el hidrógeno, y un oxidante, como el oxígeno. A diferencia de las baterías, para operar continuamente, las celdas de combustible requieren un suministro de combustible y oxidante en tiempo real.
La historia comienza a finales del siglo XVIII, cuando el científico británico William Nicholson (1753-1815) descubrió que el agua podía descomponerse en hidrógeno y oxígeno mediante la electricidad. Pero fue a principios del siglo XIX cuando se sentaron las bases de la pila de combustible moderna.
En 1839, el físico británico William Grove (1811-1896) inventó la primera celda de combustible en funcionamiento, conocida como celda Grove. Utilizaba hidrógeno como combustible y oxígeno como oxidante, y producía agua y electricidad como productos de reacción.
Durante las siguientes décadas, varios químicos hicieron contribuciones significativas a la tecnología de celdas de combustible, Francis Thomas Bacon (1904-1992), Wilhelm Ostwald (1853-1932), Karl Kordesch (1922-2011).
En 1889, el investigador alemán Ludwig Mond (1839-1909) desarrolló una pila de combustible a base de gas, utilizando monóxido de carbono como combustible.
En 1965, la misión espacial Gemini 5 fue la primera en utilizar una celda de combustible de membrana de intercambio de protones (PEMFC) a bordo de su nave espacial.
Desde entonces, se han desarrollado diferentes tipos de pilas de combustible, incluyendo pilas de combustible alcalinas, PEMFC, de óxido sólido y de carbonato fundido, cada una de las cuales presenta ventajas en diversos campos, como el espacio, los vehículos eléctricos, los sistemas de respaldo, etc. aplicaciones estacionarias.
El uso del término "pila de combustible" enfatiza el proceso electroquímico que ocurre dentro del dispositivo, más que el tipo específico de combustible utilizado. La pila de combustible proporciona electricidad de forma continua siempre que se le suministre en tiempo real combustible y oxidante. A diferencia de las baterías, la pila de combustible no almacena energía eléctrica y, por lo tanto, no necesita recargarse. Por otro lado, es necesario almacenar y transportar adecuadamente el combustible para su uso continuo.
El término "combustible" se usa de manera amplia para abarcar diferentes tipos de combustibles que se pueden usar, como hidrógeno (H2), metanol (CH3OH), metano (CH4), propano (C3H8), gas sintético, una mezcla de monóxido de carbono ( CO) e hidrógeno (H2), etc. La terminología general de "pila de combustible" permite incluir otros compuestos químicos en el futuro.
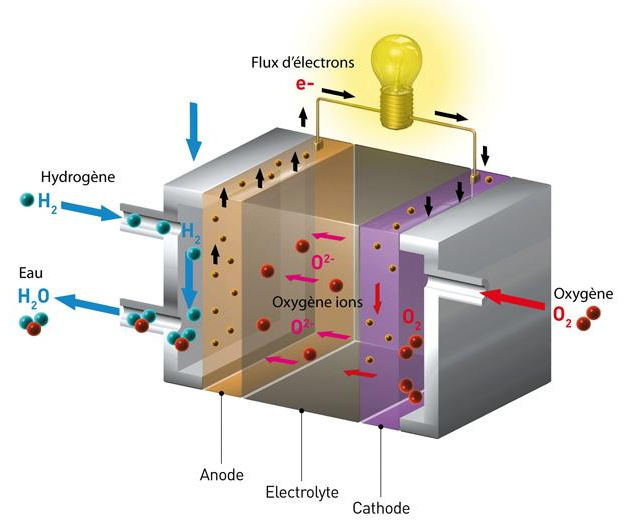
La celda de combustible de hidrógeno-oxígeno, también conocida como celda de combustible de membrana de intercambio de protones (PEMFC), requiere un suministro continuo de hidrógeno y oxígeno.
El hidrógeno se suministra al ánodo (electrodo negativo), mientras que el oxígeno (a menudo aire) se suministra al cátodo (electrodo positivo).
Los dos electrodos están separados por una membrana de polímero conductor de iones, llamada electrolito.
En el ánodo, el hidrógeno se descompone en iones de hidrógeno (protones H+) y electrones (e-) mediante una reacción de disociación, catalizada por un material como el platino. El catalizador en el ánodo facilita esta reacción (2H2 → 4H+ + 4e-).
Luego, los protones se transportan a través de la membrana de intercambio de protones (PEM) al cátodo, mientras que los electrones se ven obligados a fluir a través de un circuito externo, creando una corriente eléctrica que se puede usar para alimentar dispositivos eléctricos.
Así, los electrones proporcionan electricidad, luego se unen al cátodo donde participan en la reacción de reducción con los protones y el oxígeno para formar agua.
El catalizador del cátodo, normalmente platino aleado con otros metales, facilita esta reacción (O2 + 4H+ + 4e- → 2H2O).
El agua producida en el cátodo, así como el exceso de hidrógeno y el oxígeno no consumido, son evacuados de la pila de combustible en forma de vapor de agua y aire. La ecuación general para la reacción química en una celda de combustible de hidrógeno-oxígeno es 2H2 (hidrógeno) + O2 (oxígeno) → 2H2O (agua).
El hidrógeno es el elemento más abundante en el universo, pero no está disponible como hidrógeno libre en la Tierra. Sin embargo, puede ser producido a partir de diversas fuentes (electrólisis del agua, reformado de hidrocarburos, etc).
Las pilas de combustible de hidrógeno-oxígeno tienen una alta eficiencia energética, lo que significa que pueden convertir gran parte de la energía química contenida en los enlaces de hidrógeno en electricidad.
Estas pilas de combustible pueden convertir entre el 40% y el 60% de la energía química del hidrógeno en electricidad utilizable. El resto de la energía se disipa en forma de calor. A modo de comparación, la eficiencia de los motores de combustión interna tradicionales está entre el 25% y el 40%.
En el agua, la energía de enlace es relativamente alta en comparación con otras energías de enlace molecular. La interacción entre los átomos de hidrógeno y el átomo de oxígeno forma un enlace covalente polarizado. Esta polaridad fortalece la interacción entre los átomos, aumentando así la energía de enlace. En la molécula de agua, el oxígeno es más electronegativo que el hidrógeno, lo que significa que atrae los electrones compartidos con más fuerza hacia el enlace, creando así una carga parcial negativa en el oxígeno y una carga parcial positiva en los hidrógenos. La energía de enlace covalente promedio entre el átomo de hidrógeno y el átomo de oxígeno es de aproximadamente 460 kilojulios por mol (kJ/mol). Parte de esta energía se convierte en energía eléctrica mediante el proceso de reacción electroquímica en la pila de combustible.
Así, el hidrógeno se considera el combustible ideal para las pilas de combustible debido a su alto potencial de eficiencia energética y reducción de emisiones.