A luz é a única informação que os cientistas têm à sua disposição para entender o mundo que nos rodeia. Ao longo dos séculos, observando a luz solar, os cientistas têm feito "falar" a luz. Já em 1670, Isaac Newton olha a luz solar branca através de um prisma de vidro e descobre que o feixe de luz é decomposto. Ele acha que a luz é composta de partículas. Em 1676, Ole Christensen Rømer (1644-1681) determina a velocidade da luz através a observação das luas de Júpiter.
Em 1690, Christian Huygens (1629-1695) indica que a luz é constituído por uma série de ondas propagadas através do éter, o substrato imaterial que suporta o vácuo para transmitir a luz. Em 1801, Thomas Young (1773-1829), recebeu um padrão de interferência (imagem contra), mostrando que a luz é uma onda, porque as ondas podem somar e subtrair para fazer interferências (áreas escuras intercaladas áreas claras). Esta experiência permite-nos compreender o comportamento ea natureza da luz.
Em 1814, Joseph von Fraunhofer (1787-1826) notas das linhas na luz visível do espectro solar. Este físico alemão e oftalmologista é o primeiro a estudar a difração da luz por redes ópticas (difração de Fraunhofer). Neste momento, não se sabe por que a presença dessas linhas no espectro de luz visível. A resposta chegará muito mais tarde.
Em 1850, Robert Wilhelm Bunsen (1811-1899) e Gustav Kirchhoff Robert (1824-1887) descobrem que as linhas espectrais da luz emitida por um corpo incandescente, constituem uma assinatura para identificar este corpo. Observando-se o espectro da luz solar, eles reconhecem vários elementos químicos na Terra cuja, o césio e o rubídio.
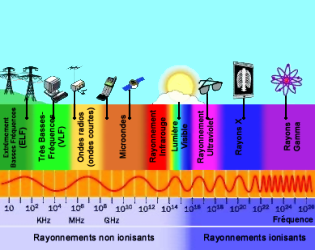
Em 1864, James Clerk Maxwell (1831-1879) fez uma síntese das ondas elétricas e eletromagnéticas. Ela determina que a luz é uma onda eletromagnética e que todo o espectro eletromagnético é luz. O que os diferencia as ondas eletromagnéticas entre eles, é o comprimento de onda. As várias janelas do espectro electromagnético é caracterizada por uma gama de comprimentos de onda, mas também uma gama de frequências.
Em 1900, Max Planck resolve o enigma do corpo negro, a sua fórmula descreve perfeitamente a luz emitida por um corpo em função da temperatura. Em outras palavras, a uma temperatura elevada indica uma alta energia, uma baixa temperatura indica uma baixa energia.
Em 1905, Albert Einstein (1879-1955) explicou o efeito fotoelétrico, são fótons da luz incidente que rasgam os elétrons em materia. Os fótons funcionam como quanta de energia, que Planck havia sugerido, mas é Einstein que o mostra. Então, esses fótons têm um pouco de energia, ela vai puxar os elétrons do metal. Quando chegarmos em nossa pele, os raios de luz do sol, sentimos bem a energia que eles carregam. A luz é, portanto, constituído de fótons de comportamento de onda e cada um de estes fótons corresponde uma energia. Mais o comprimento de onda do fóton é curto e mais é energético. | | Em 1911, Ernest Rutherford (1871-1937) indica a estrutura do átomo e dá o tamanho do núcleo atómico da ordem de 10-14 metros.
Em 1913, Niels Bohr (1885-1962) propôs a estrutura do átomo de hidrogênio, os elétrons estão localizados em órbitas quantificadas. O electrão navega a uma distância, em uma das camadas de pele de cebola em torno do núcleo. Este é o princípio de absorção e emissão de luz em um átomo (veja o próximo capítulo).
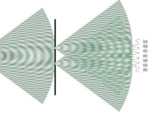
A experiência da dupla fenda de Thomas Young (1773-1829) que remonta ao início do século 19, é um experimento de física que consiste a hazer interferir dois feixes de luz a partir da mesma fonte. Este experimento feito em 1821 com fótons foi realizada com todas as partículas. Com elétrons na década de 1920, com nêutrons na década de 1950, com átomos na década de 1980 e com as moléculas na década de 1990. Todas as partículas microscópicas são susceptíveis de interferir como no Experimento de Young.
N.B.: Energia do fóton E = hν = hc / λ.
E é a energia expressa em joules, h é a constante de Planck (6,62 x 10-34), ν é a frequência (número de oscilações eletromagnéticas), c é a velocidade da luz no vácuo e λ é comprimento de onda. A energia de um fóton é infinitamente pequena. Em outras palavras, mais o comprimento de onda é curta, mais a frequência é elevada e mais a energia é poderosa. Imagem: A natureza da luz pertence a mecânica quântica para o qual é uma partícula e uma onda. A luz tem um comprimento de onda, o que determina a cor, o vermelho emite no comprimento de onda de 700 nanómetros, o violeta de 450 nm. É nesta pequena janela vemos o mundo, mas a luz invisível está espalhada por um campo eletromagnético maior. A emissão de luz é a emissão fóton, quando o átomo passeia de um nível de energia a um outro. O espectro de emissão de um elemento pode ser obtida por aquecimento do elemento, e depois analisando a radiação emitida pela materia. Este espectro é característico do elemento. | | 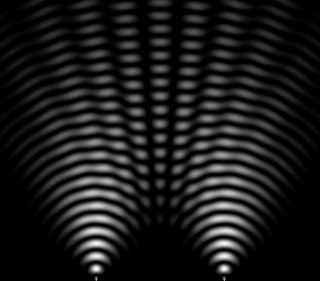 Imagem: Experiência da dupla fenda de Thomas Young ou interferência Young é um experimento de física que haze interferir dois feixes de luz a partir da mesma fonte. Para fazer isso, a luz passa através de duas pequenas aberturas perfuradas em um painel opaco. Os fótons de luz passam através dos dois furos e, portanto, andam por um caminho diferente. Quem passam por um buraco vão chegar juntos, as ondas vão se somam, portanto, haverá ampliação de luz que marcará gradualmente "tela fotográfica." Aqueles que passam por outro buraco vai llegar deslocou no tempo em relação aos primeiros e também as ondas serám adicionadas, mas duas ondas opostas cancelar-se é o que mostra as franjas negras do fenômeno de interferência.
 |
Em 1913, Niels Bohr (1885-1962) propôs a estrutura do átomo de hidrogênio, os elétrons estão localizados em órbitas quantificadas (modelo de Bohr).
O electron externo navega a uma distância, em uma camada de pele de cebola em torno do núcleo. Bohr mostra que este elétron pode ser alguns saltos de uma camada quantificada para a outra. Por que o elétron em uma camada alta, salteia sobre uma camada interna, ele deve ter uma energia igual à a diferença de energia entre as duas camadas quantificadas. Se as energias envolvidas são moderadas, só nuvem eletrônica externa de elétrons estão em causa. Um feixe de luz é uma onda que se propaga como um conjunto de partículas, chamado fotões. A quantidade de energia transportada pelo fóton é chamado quantum de energia. A quantidade de energia transportada pelo fotão é chamado quantum de energia.
Quando o fotão chega no átomo, átomo absorve o fotão então encontramos uma linha de absorção. O elétron mudou camada não está em condição estável e vai tentar voltar à sua camada original. Quando os electrões retorna para a camada inicial, um fotão é emitido, o átomo perde da energia e faz-se observar uma linha de emissão.
O elétron é devolvido sobre sua camada original e recuperou suo estado fundamental transmitendo a energia que ele tinha recebido igual à diferença de energia entre as duas camadas quantificadas. O movimento de elétrons de uma camada para outra, vai destacar as linhas de absorção e emissão espectral. | | Luz, onda, partículas, energia e matéria estão relacionados a este fenômeno absorção e emissão atômica.
O átomo resulta da interação entre um núcleo e elétrons, em outras palavras, é um sistema ligada de partículas que têm energia.
Quando há contribuição de energia ou perda de energia, a matéria reage por absorção ou emissão uma onda de luz.
N.B.: Na física clássica, os átomos consistem de um número de elétrons pontuales carregados negativamente e um núcleo cuasi pontual, com carga positiva, mas isso levanta um paradoxo. Na física clássica, a materia deve desaparecer, aniquilar-se, porque um elétron que irradia em torno de um núcleo perde energia (teoria de Maxwell) e, portanto, deve cair sobre o núcleo. Isto significa que a estabilidade de um átomo não é compreensível no contexto da teoria clássica. Por contras, a física quântica explica o mistério do átomo e a estabilidade da matéria. A física quântica já apareceu entre 1925 e 1927, ela deriva da da mecânica quântica iniciada por Max Planck em 1900, em seguida, desenvolvida por Albert Einstein, Niels Bohr, Arnold Sommerfeld, Hendrik Anthony Kramers, Werner Heisenberg, Wolfgang Pauli e Louis de Broglie entre 1905 e 1924. Esta revolução científica e conceitual que explica a existência da matéria, é a base da nossa compreensão física do mundo. | | 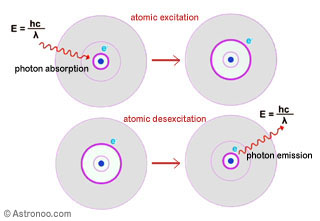 Imagem: Princípio da absorção e emissão de um fóton. Se a energia envolvida é moderada, as transições electrónicas fazem-se somente em as capas exteriores de átomos. Eles correspondem à passagem de um elétron da subcapa não preenchida a uma capa desocupado de energia superior (absorção) ou o retorno de um elétron em a subcapa de valência (emissão). Se a energia envolvida é suficientemente elevada (nas muito altas frequências), há extracção de electrões.
Crédito imagem : www.astronoo.com |
 Tradução automática
Tradução automática





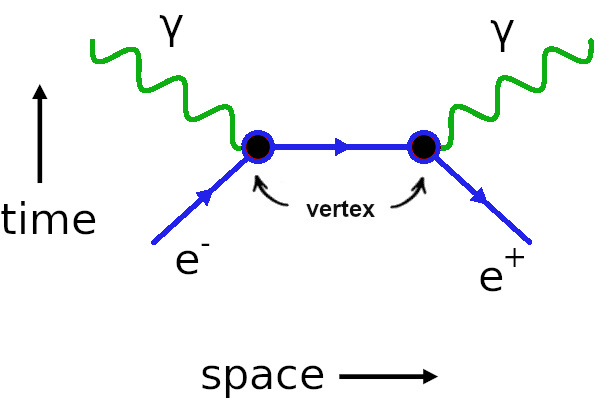 Diagramas de Feynman e física de partículas
Diagramas de Feynman e física de partículas
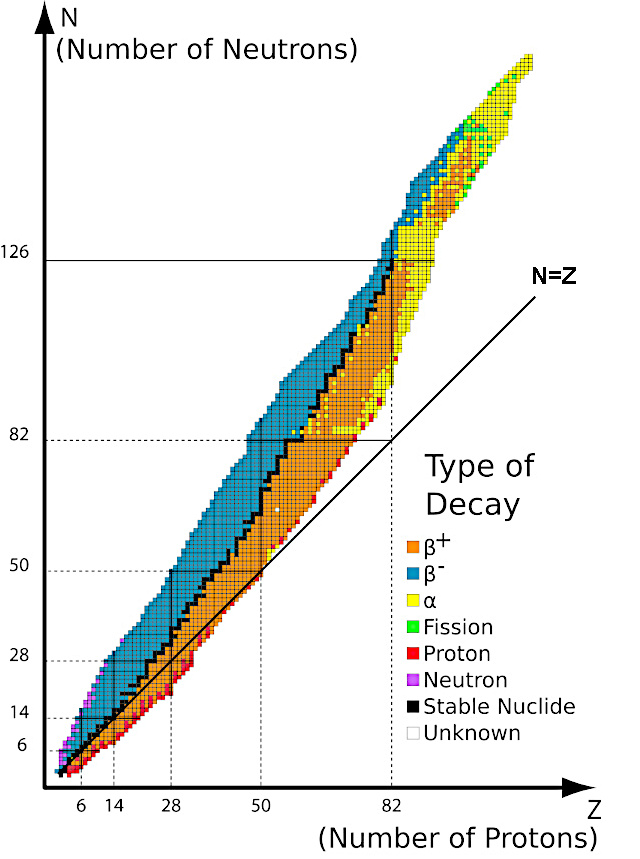 As estrelas não podem criar elementos mais pesados que o ferro por causa da barreira de instabilidade nuclear
As estrelas não podem criar elementos mais pesados que o ferro por causa da barreira de instabilidade nuclear
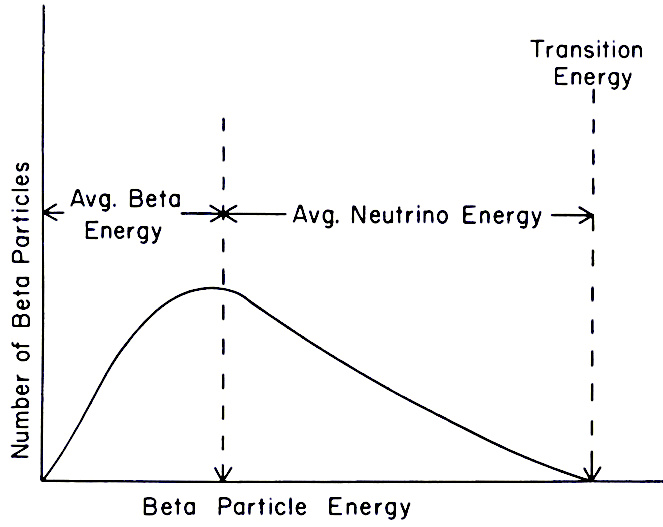 O que é radioatividade β?
O que é radioatividade β?
 Teoria da parede de Planck
Teoria da parede de Planck
 O vazio é realmente vazio?
O vazio é realmente vazio?
 O Grande Colisor de Hádrons
O Grande Colisor de Hádrons
 O hádron não é um objeto fixo
O hádron não é um objeto fixo
 Radioatividade, natural e artificial
Radioatividade, natural e artificial
 A escala das nanopartículas
A escala das nanopartículas
 Gato de Schrodinger
Gato de Schrodinger
 Antes do big bang, o multiverso
Antes do big bang, o multiverso
 Inflação eterna
Inflação eterna
 Ondas gravitacionais
Ondas gravitacionais
 Princípio de emissão e absorção atômica
Princípio de emissão e absorção atômica
 Além dos nossos sentidos
Além dos nossos sentidos
 O que é uma onda?
O que é uma onda?
 Os campos da realidade: o que é um campo?
Os campos da realidade: o que é um campo?
 Espaço no tempo
Espaço no tempo
 Calculadora ou computador quântico
Calculadora ou computador quântico
 Condensado de Bose-Einstein
Condensado de Bose-Einstein
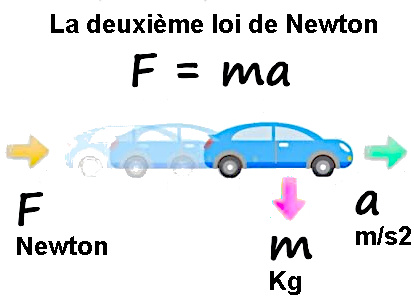 Equação das três leis de Newton
Equação das três leis de Newton
 Conceito de campo em física
Conceito de campo em física
 O elétron, uma espécie de ponto elétrico
O elétron, uma espécie de ponto elétrico
 Entropia e desordem
Entropia e desordem
 Luz, toda a luz do espectro
Luz, toda a luz do espectro
 A jornada infernal do fóton
A jornada infernal do fóton
 Mistério do Big Bang, o problema do horizonte
Mistério do Big Bang, o problema do horizonte
 O neutrino e a radioatividade beta
O neutrino e a radioatividade beta
 Espaço-tempo de Einstein
Espaço-tempo de Einstein
 A incrível precisão do segundo
A incrível precisão do segundo
 Por que a física tem constantes?
Por que a física tem constantes?
 Espectroscopia, uma fonte inesgotável de informações
Espectroscopia, uma fonte inesgotável de informações
 Abundância de elementos químicos no universo
Abundância de elementos químicos no universo
 Efeitos da aberração da luz
Efeitos da aberração da luz
 O tamanho dos átomos
O tamanho dos átomos
 A ordem magnética e magnetização
A ordem magnética e magnetização
 O confinamento de quarks
O confinamento de quarks
 Superposições de estados quânticos
Superposições de estados quânticos
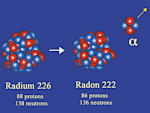 Emissão alfa (α)
Emissão alfa (α)
 Equação de indução eletromagnética
Equação de indução eletromagnética
 Fusão nuclear, fonte de energia natural
Fusão nuclear, fonte de energia natural
 A matéria escura existe?
A matéria escura existe?
 Matéria não bariônica
Matéria não bariônica
 O mistério da estrutura do átomo
O mistério da estrutura do átomo
 O mistério da matéria, de onde vem a massa
O mistério da matéria, de onde vem a massa
 Energia nuclear e urânio
Energia nuclear e urânio
 O Universo dos raios X
O Universo dos raios X
 Quantos fótons para aquecer um café?
Quantos fótons para aquecer um café?
 Imagem do átomo de ouro, microscópio de corrente de tunelamento
Imagem do átomo de ouro, microscópio de corrente de tunelamento
 Efeito túnel da mecânica quântica
Efeito túnel da mecânica quântica
 As 12 partículas de matéria
As 12 partículas de matéria
 Átomo ou orbital atômico
Átomo ou orbital atômico
 Radioatividade da Terra
Radioatividade da Terra
 O Segundo intercalar
O Segundo intercalar
 O vácuo tem energia considerável
O vácuo tem energia considerável
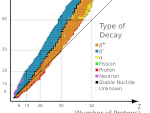 O vale da estabilidade dos núcleos atômicos
O vale da estabilidade dos núcleos atômicos
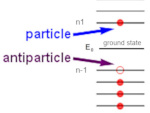 Antimatéria e antipartícula
Antimatéria e antipartícula
 O que é uma carga elétrica?
O que é uma carga elétrica?
 Nossa matéria não é quântica!
Nossa matéria não é quântica!
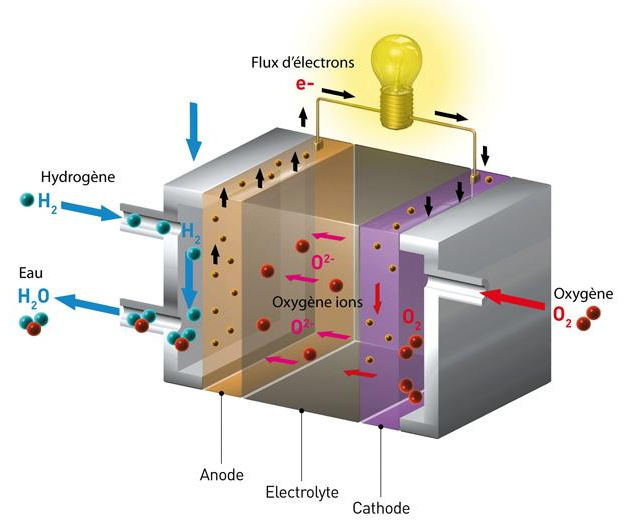 Por que usar hidrogênio na célula de combustível?
Por que usar hidrogênio na célula de combustível?
 Os segredos da gravidade
Os segredos da gravidade
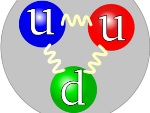 E=mc2 explica a massa do próton
E=mc2 explica a massa do próton
 Imagem da gravidade desde Albert Einstein
Imagem da gravidade desde Albert Einstein
 O ano milagroso de Einstein: 1905
O ano milagroso de Einstein: 1905
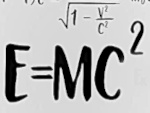 O que a equação E=mc2 realmente significa?
O que a equação E=mc2 realmente significa?
 Relatividade especial e espaço e tempo
Relatividade especial e espaço e tempo